 Ein
bei
Aldi Nord erhältlicher Reis weist nach Laborprüfungen von Greenpeace
Genmanipulationen auf. Vermutlich handelt es sich um eine Sorte, die in keinem
Land für den menschlichen Verzehr zugelassen ist. (11.09.2006, 15:00 Uhr)
Ein
bei
Aldi Nord erhältlicher Reis weist nach Laborprüfungen von Greenpeace
Genmanipulationen auf. Vermutlich handelt es sich um eine Sorte, die in keinem
Land für den menschlichen Verzehr zugelassen ist. (11.09.2006, 15:00 Uhr)
Extraktion von DNA-Probenmaterial aus verschiedenen Organismen
PCR (Polymerase-Chain-Reaction = Polymerasen Kettenreaktion)
Beobachtung zum Versuch mit Sojamehl
Beobachtung Versuch mit Sojasprossen
Bitte benutzen Sie die obigen Links zur Navigation, um zu Ihrer gewünschten Stelle zu springen, oder lesen Sie das ganze Protokoll indem Sie einfach runterscrollen.
Bio Protokoll zu Versuch D Untersuchung von GMO ( Genetic Modifed Organism = Genetisch Veränderte Organismen)
Inhaltsverzeichniss:
Einleitung
Extraktion von DNA- Probenmaterial aus verschiedenen Organismen
PCR ( Polymerase- Chain- Reaction = Polymerasen Kettenreaktion)
Erklärung der PCR
Elektrophoretische Trennung der PCR Produkte
Beobachtung zum Versuch mit Sojamehl
Erklärung der Taschen
Zusammenfassung
Fehleranalyse
Beobachtung Versuch mit Sojasprossen
Erklärung der Taschen
Anmerkung: Reis und Papaya
Fazit
Anlagen
„ Genmanipulierte Lebensmittel
Greenpeace entdeckt illegalen Reis
 Ein
bei
Aldi Nord erhältlicher Reis weist nach Laborprüfungen von Greenpeace
Genmanipulationen auf. Vermutlich handelt es sich um eine Sorte, die in keinem
Land für den menschlichen Verzehr zugelassen ist. (11.09.2006, 15:00 Uhr)
Ein
bei
Aldi Nord erhältlicher Reis weist nach Laborprüfungen von Greenpeace
Genmanipulationen auf. Vermutlich handelt es sich um eine Sorte, die in keinem
Land für den menschlichen Verzehr zugelassen ist. (11.09.2006, 15:00 Uhr)
Hamburg/Brüssel - Der bei Aldi Nord erhältliche Langkornreis der Marke Bon-Ri
aus den USA sei gegen das von Bayer hergestellte Unkrautvernichtungsmittel
Liberty Link resistent. Sehr wahrscheinlich handle es sich um die Sorte LLRice
601, die in keinem Land für den menschlichen Verzehr zugelassen und nicht
abschließend auf Gefahren für Umwelt und Gesundheit getestet sei.
Die EU-Kommission in Brüssel forderte die Lebensmittelindustrie der 25
Mitgliedstaaten auf, mit Tests und Kontrollen möglichen Importen von LLRice 601
nachzugehen. Dies teilte ein Sprecher von Verbraucherschutzkommissar Markos
Kyprianou nach einem Treffen von Lebensmittelexperten der Kommission mit
Industrievertretern mit.
Im August war die Auslieferung von 20.000 Tonnen Reis aus den USA in Rotterdam
gestoppt worden, weil die Ladung im Verdacht stand, LLRice 601 zu enthalten. Die
Kommission hatte zuvor für alle Ladungen von Langkornreis aus den USA einen
Nachweis angeordnet, dass keinerlei gentechnisch veränderte Ware enthalten ist.
Die Brüsseler Behörde schließt aber nicht aus, dass schon vor dieser Anordnung
Gen-Reis aus den USA auf den europäischen Markt gelangt sein könnte. Das
US-Landwirtschaftsministeriums und Bayer beteuerten, der Reis berge keine Gefahr
für Mensch und Umwelt.
(tso/AFP)
“ (http://www.tagesspiegel.de/wirtschaft/nachrichten/genmanipulierte-lebensmittel/73592.asp)
Aufgrund dieses aktuellen Anlasses fragten wir uns, ob es auch andrere Lebensmittel aus unserem Alltag genmanipuliert sind. Deswegen testeten wir Lebensmittel wie Sojasprossen, Sojamehl, Papaja und den Bon-Ri Reis von Aldi auf Genmanipulation. Allerdings können wir nur zu 85% nachweisen, ob es sich um ein genetisch verändertes Produkt handelt. (siehe S.3)
Bei gentechnisch veränderten Nahrungsmitteln wird das Produkt so optimiert, dass z.B. eine Tomate nicht mehr matschig werden kann. Dies macht die Tomate für den Verbraucher attraktiver.
Um Lebensmittel auf gentechnische Veränderungen zu testen, bedient man sich der Methoden des "genetischen Fingerabdrucks".
Unsere Versuche
Extraktion von DNA -Probenmaterial aus verschiedenen Organismen
Chemikalien:
Destilliertes Wasser, Sojamehl, Screwcap tube mit 500 µl InstaGene Matrix
Materialien:
Eppendorfpipetten 2-20 µl , Mörser und Pistell, Eppendorfgefäße, Markerstift, Wasserbad mit einer Temperatur von 95-100°C, Zentrifuge, Waage, Eis, Uhr und Schwimmer
Durchführung:
1. Ansatz von 2 Proben
Probe 1:Von der Firma BioRad zertifiziert nicht genverändertes Pflanzenmaterial mit 10 ml destiliertem Wasser gemischt
Probe 2: 1,9 g Lebensmittel (Sojamehl, frische Papaja, Reis und frische Sojasprossen) mit 9,5 ml destiliertem Wasser gemischt
Das Probenmaterial wird gemörsert.
2. Von beiden Proben werden 50 µl in jeweils 500 µl InstaGene Matrix (negativ geladen um die Metallionen wie Mg2+ binden, welche notwendig sind für enzymatische Reaktionen, welche die DNA langsam abbauen) gegeben.
3. Beide Proben werden bei 95 °C jeweils für 5 Minuten in einem Wasserbad erhitzt, zur Denaturierung der DNAasen. Hierbei werden die Enzyme, welche die DNA abbauen, zerstört.
4. Die Proben werden 5 Minuten bei maximaler Geschwindigkeit zentrifugiert, damit die Pellets der IstaGene Matrix abzentrifugiert werden.
5. Die Proben werden auf Eis gestellt, um die DNA nicht zu zerstören.
PCR (Polymerase-Chain-Reaction= Polymerasen-Kettenreaktion)
Chemikalien:
Plant Master Mix (Die Primer des Plant Master Mix können an Pflanzenspezifischen Basensequenzen binden, dadurch kann man feststellen ob Pflanzen-DNA extrahiert wurde oder nicht), GMO Master Mix (Die Primer des GMO Master Mix können an genveränderter DNA binden, dadurch kann man feststellen, ob das DNA-Material verändert wurde. Allerdings können sich diese Primer nur bei 85% aller genetisch veränderten Pflanzen anlagern.), Probe 1 und 2, GMO Postive Controll DNA (von der Firma BioRad als Kontrolle) und Öl.
Materialien:
6 Screwcap-Gefäße, Eppendorfpipetten 2-20 µl, 3 Wasserbäder mit jeweils 95 °C, 59 °C und 72 °C, Schwimmer und Uhr
Durchführung:
1. Es werden die 6 Screwcap-Gefäße befüllt:
1: 20 µl Plant MM + 20 µl Non GMO food Controll DNA (Probe 1) + 4 µl Öl
2: 20 µl GMO MM+ 20 µl Non GMO food Controll DNA (Probe 1) + 4 µl Öl
3: 20 µl Plant MM + 20 µl Test Food DNA (Probe 2) + 4 µl Öl
4: 20 µl GMO MM + 20 µl Test Food DNA (Probe 2) + 4 µl Öl
5: 20 µl Plant MM + 20 µl GMO Positive Controll DNA + 4 µl Öl
6: 20 µl GMO MM + 20 µl GMO Positive Controll DNA + 4 µl Öl
Das Öl soll hierbei das Verdampfen der Proben bei der PCR verhindern.
2. Die PCR wird in 40 Zyklen durchgeführt.
Die 3 Wasserbäder haben jeweils die Funktion von Trennen (95°C), Anlagern (59°C) und Verlängern (72°C) der DNA. Gesamtdauer der PCR: 180 Minuten.
1. Zyklus (95°C) Wasserbad 3min
(59°C) Wasserbad 1min
(72°C) Wasserbad 2min
2.-39. Zyklus (95°C) Wasserbad 1min
(59°C) Wasserbad 1min
(72°C) Wasserbad 2min
40. Zyklus (95°C) Wasserbad 1min
(59°C) Wasserbad 1min
(72°C) Wasserbad 12min
Erklärung der PCR:
Das 95°C Wasserbad denaturiert den DNA-Strang.
Das 59°C Wasserbad sorgt dafür, dass sich die Primer an die DNA-Primersequenzen anlagern.
Im 72°C Wasserbad verlängert die TAQ-Polymerase die DNA-Stränge.
Elektrophoretische Trennung der PCR Produkte
Elektrophorese:
Bezeichnet die Wanderung elektrisch gelandener Teilchen durch ein Agarosegel in einem elektrischem Feld, das durch eine Spannung von 100 Volt erzeugt wird. Je länger eine Basensequenz ist, desto langsamer wandert sie in dem Agarosegel.
Herstellung und Gießen des Agarosegels:
30 ml des zehnfach konzentrierten TBE-Puffer wird mit 270 ml destilliertem Wasser verdünnt.
30 mg Agarose werden mit 30 ml des einfach konzentrierten Elektrophoresepuffers gemischt.
Anschließend wird die Agarose durch Kochen in einem Wasserbad gelöst.
Danach wird die Agarose auf 50 °C abgekühlt. Das Agarosegel wird in die Elektrophoresekammer gegeben, sodass es 7-8 mm hoch ist. Anschließend werden Kämme in das Gel gesteckt, welche die späteren Taschen erzeugen. Die Aushärtung des Gels dauert etwa 20 Minuten. Dann werden die Kämme entfernt.
Herstellung des AzurB-Chlorid:
500 ml destilliertes Wasser wird mit 1 ml AzurB-Chlorid verdünnt.
Chemikalien: 6 Screwcap-Gefäße mit den Ansätzen, 1 Eppendorfgefäß mit PCR Molecular Weight Rouler (DNA-Marker, welcher DNA-Fragmente mit bekannter Länge enthält, um festzustellen welche Ergebnisse erzielt wurden), Azur-B-Chlorid Färbelösung
Materialien: Elektrophoresekammer mit Agarose-Gel, Eppendorfpipette, Netzgerät + Stecker, Petrischale
Durchführung:
1. Der Inhalt der Screwcap-Gefäße wird in die einzelnen Taschen der Elektrophoresekammern gegeben, wobei jede zweite Kammer ausgelassen wird, um ein deutlicheres Ergebnis zu erzielen und die Proben sich nicht vermischen.
2. Die Elektrophoresekammer wird an das Netzgerät mit 100 Volt angeschlossen
3. Nach 30 Minuten Laufzeit wird das Gel in einer Petrischale mit der Färbelösung gefärbt.
Beobachtung Versuch Sojamehl:
|
Non GMO food controll with plant primers |
Non GMO food controll with GMO primers |
Test food with plant primers |
Test food with GMO primers |
GMO positive DNA with plant primers |
GMO postive DNA with GMO primers |
PCR molecular weight ruler |
|
Bahn 1 |
Bahn 2 |
Bahn 3 |
Bahn 4 |
Bahn 5 |
Bahn 6 |
Bahn 7 |
|
/ |
|
|
|
|
|
0,75 mm |
|
/ |
|
|
|
|
|
0,95 mm |
|
1,1 mm |
/ |
/ |
/ |
1,1 mm |
|
1,1 mm |
|
/ |
|
|
|
|
1,55 mm |
1,55 mm |
|
/ |
|
|
|
|
|
1,65 mm |
Erklärung der Taschen
Bahn 1: Eine Bande zeigt, ob DNA extrahiert wurde. Jede Pflanze besitzt einen für Pflanzen charakteristischen DNA-Abschnitt an den der Plant-Primer bindet. Deshalb erwarten wir dort eine Bande.
Bahn 2: Wir erwarten keine Bande, da ein GMO Primer eingesetzt wurde. Eine Bande würde zeigen, dass wir unsauber gearbeitet haben. Dass das verwendete Pflanzenmaterial garantiert nicht genetisch verändert ist, wurde uns von BioRad zertifiziert.
Bahn 3: Eine Bande zeigt, ob wir aus aus unserer Sojamehl-Probe DNA extrahiert haben. Jede Pflanze besitzt einen für Pflanzen charakteristischen DNA-Abschnitt an den der Plant-Primer bindet. Deshalb erwarten wir dort eine Bande.
Bahn 4: Eine Bande zeigt, ob unsere Probe genetisch verändert ist.
Bahn 5: Eine Bande zeigt, ob die Plant Primer gebunden haben und ob die PCR funktioniert hat.
Bahn 6: Eine Bande zeigt, ob die GMO Primer gebunden haben und die PCR funktioniert hat.
Bahn 7: DNA Marker
Zusammenfassung:
Wir konnten mit Erfolg DNA extrahieren, da wir in Bahn 1 eine Bande erhalten haben und in Bahn 2 keine. Außerdem haben der Plant-(Bahn 5) und der GMO-Primer (Bahn 6) gebunden, und die PCR hat funktioniert.
Fehleranalyse:
Das Sojamehl wurde zuvor schon zu stark bearbeitet, was zur Folge haben kann, dass die DNA größtenteils zerstört wurde.
Desweiteren hätte man zügiger und in kreisenden Bewegungen mörsern können und die Mörser hätten besser gereinigt werden sollen, wie z.B. mit Ethanol.
Die Proben hätten außerdem vor jeder Verwendung nochmals kurz zentrifugiert werden können.
Ein Arbeiten unter Hygienestandarts wie z.B. in Laboren hätte das Ergebnis wahrscheinlich auch besser ausfallen lassen.
Beobachtung Versuch Sojasprossen:
Bahn 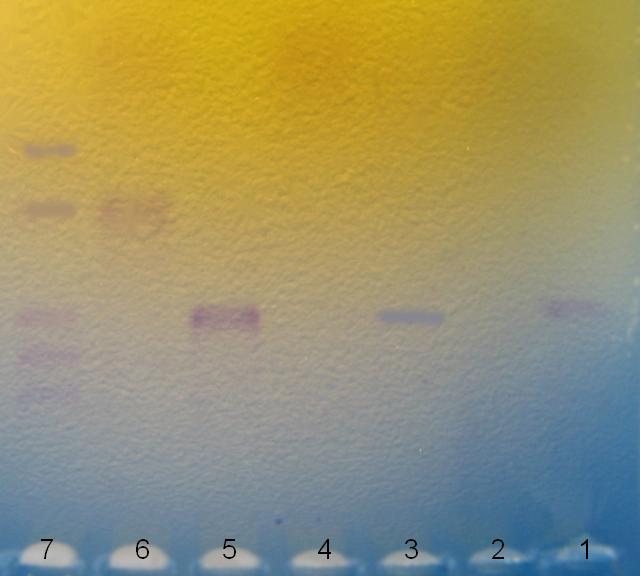
Bahn 1: Non GMO food controll with plant primers
Bahn 2: Non GMO food controll with GMO primers
Bahn 3: Test food with plant primers
Bahn 4: Test food with GMO primers
Bahn 5: GMO positive DNA with plant primers
Bahn 6: GMO postive DNA with GMO primers
Bahn 7: PCR molecular weight ruler
Der Versuch mit den Sojasprossen hat funktioniert, es konnten folgende Banden gesehen werden:
|
Non GMO food controll with plant primers |
Non GMO food controll with GMO primers |
Test food with plant primers |
Test food with GMO primers |
GMO positive DNA with plant primers |
GMO postive DNA with GMO primers |
PCR molecular weight ruler |
|
Bahn 1 |
Bahn 2 |
Bahn 3 |
Bahn 4 |
Bahn 5 |
Bahn 6 |
Bahn 7 |
|
/ |
|
|
|
|
|
0,75 mm |
|
/ |
|
|
|
|
|
0,95 mm |
|
1,1 mm |
/ |
1,1 mm |
/ |
1,1 mm |
|
1,1 mm |
|
/ |
|
|
|
|
1,55 mm |
1,55 mm |
|
/ |
|
|
|
|
|
1,65 mm |
Erklärung der Taschen
Bahn 1: Eine Bande zeigt, ob DNA extrahiert wurde. Jede Pflanze besitzt einen für Pflanzen charakteristischen DNA-Abschnitt an den der Plant-Primer bindet. Deshalb erwarten wir dort eine Bande.
Bahn 2: Wir erwarten keine Bande, da ein GMO Primer eingesetzt wurde. Eine Bande würde zeigen, dass wir unsauber gearbeitet haben. Dass das verwendete Pflanzenmaterial garantiert nicht genetisch verändert ist, wurde uns von BioRad zertifiziert.
Bahn 3: Eine Bande zeigt, ob wir aus unserer Sojasprossen-Probe DNA extrahiert haben. Jede Pflanze besitzt einen für Pflanzen charakteristischen DNA-Abschnitt an den der Plant-Primer bindet. Deshalb erwarten wir dort eine Bande.
Bahn 4: Eine Bande zeigt, ob unsere Probe genetisch verändert ist.
Bahn 5: Eine Bande zeigt, ob die Plant-Primer gebunden haben und ob die PCR funktioniert hat.
Bahn 6: Eine Bande zeigt, ob die GMO-Primer gebunden haben und die PCR funktioniert hat.
Bahn 7: DNA-Marker
Wir konnten mit Erfolg DNA extrahieren, da wir in Bahn 1 und Bahn 3 eine Bande erhalten haben. Außerdem haben der Plant (Bahn 5) und der GMO Primer (Bahn 6) gebunden, und die PCR hat funktioniert.
Aus Bahn 4 resultiert, dass es sich um nicht gentechnisch veränderte Sojasprossen handelt.
Bei den weiteren Versuchen mit der Papaya und dem Reis konnte keine DNA extrahiert werden.
Reis: Die Extraktion von DNA bei Reis ist für unsere Verhältnisse zu schwierig.
Papaya: Wie oben in der Fehleranalyse angedeutet, wurde das Genmaterial frühzeitig beim Mörsern zerstört. Wahrscheinlich wurde deshalb keine DNA extrahiert.
Abschließend lässt sich sagen, dass die getesteten Sojasprossen nicht gentechnisch verändert sind.
Allerdings ist dies nur zu 85% sicher, da - wie oben genannt - die GMO Primer nur bei 85% der gängigen genetisch veränderten Pflanzen binden können.
Bei Reis, Papaya und Sojamehl lässt sich kein Ergebnis feststellen, da wir aus dem Pflanzenmaterial keine DNA extrahieren konnten.
Von: Marc-Philipp Fuchs, Sven Heimann, Janina Herzog, Markus Burmester, Max Rademacher
Protokollanten:
Marc-Philipp Fuchs, Sven Heimann, Janina Herzog, Markus Burmester, Max Rademacher